三羧酸循环是需氧生物体内普遍存在的代谢途径,为细胞提供能量、还原力和合成前体。由于α-酮戊二酸脱氢酶(KDH)的缺失,长期以来学术界一直认为蓝藻没有经典的三羧酸循环途径。近期的研究发现蓝藻中存在至少两条代谢旁路,即γ-氨基丁酸(GABA)途径和琥珀酸半醛(SSA)途径,使得蓝藻的三羧酸循环变得完整(图1)。然而还未有研究报道上述途径中的关键酶的酶学特征及催化机理。
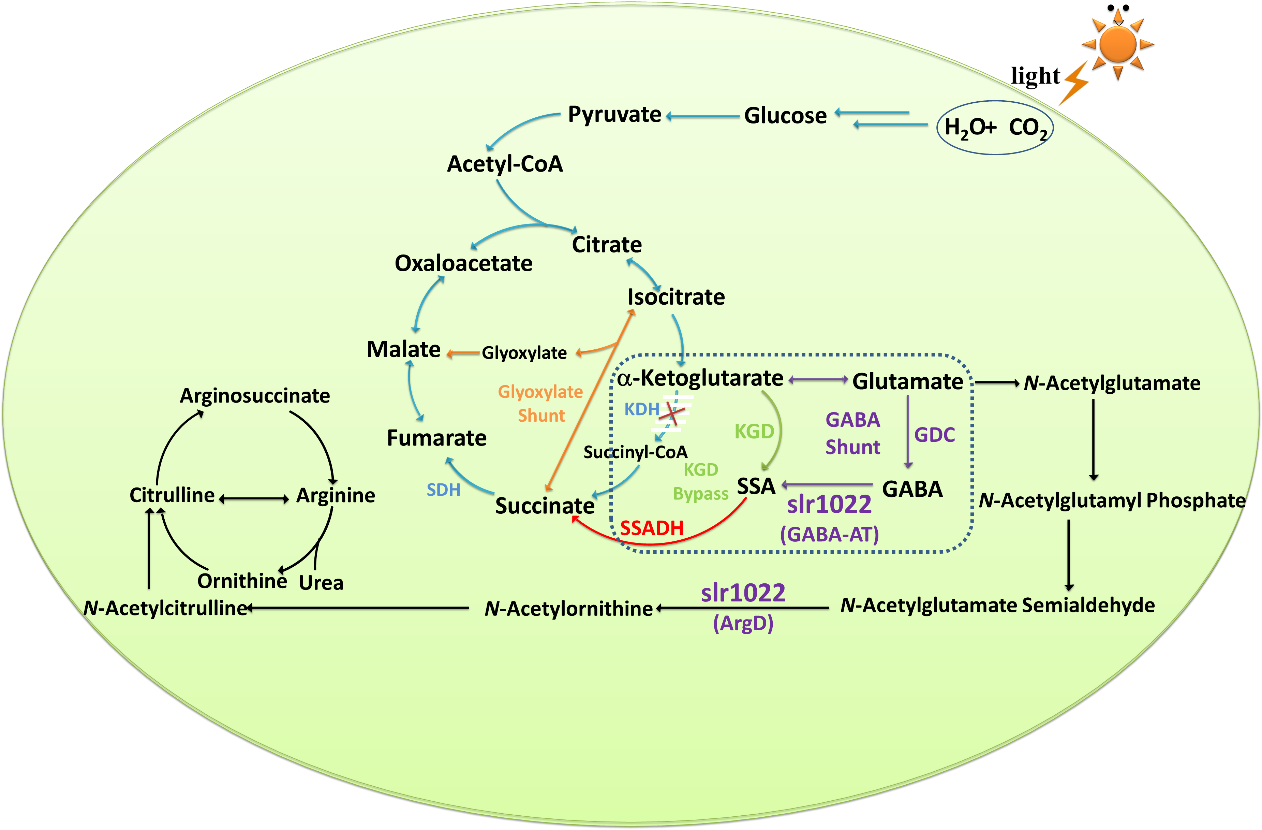
图1. 蓝藻中三羧酸循环及相关途径。KDH:α-酮戊二酸脱氢酶;SDH:琥珀酸脱氢酶;KGD:α-酮戊二酸脱羧酶;SSADH:琥珀酸半醛脱氢酶;GDC:谷氨酸脱羧酶;GABA-AT:γ-氨基丁酸转氨酶;ArgD:N-乙酰鸟氨酸转氨酶。
在国家自然科学基金委的资助下(项目编号:31400054,31560250和31860249),李志敏课题组对蓝藻三羧酸循环途径中的几个关键酶展开了系列研究。课题组研究了集胞藻PCC6803中sll1981基因编码蛋白的表达纯化和生化特征,体外确定了Sll1981蛋白具有α-酮戊二酸脱羧酶的催化功能(Protein Expression and Purification, 2017, 139: 21-28.)。课题组对聚球藻PCC7002中的α-酮戊二酸脱羧酶的底物选择性和催化特性展开了深入研究,结果发现聚球藻PCC7002中的α-酮戊二酸脱羧酶的底物选择性非常专一,在测试的α-酮酸中仅有α-酮戊二酸可以作为底物被催化,同时该酶的催化活性大约是集胞藻PCC6803中α-酮戊二酸脱羧酶的10倍左右(International Journal of Biological Macromolecules, 2018, 114: 188-193.)。
琥珀酸半醛脱氢酶(SSADH)是SSA途径和GABA途径的共同酶。课题组对来源于鱼腥藻PCC7120和蓝杆藻ATCC51142的SSADH展开了动力学和结构模拟研究。结果发现这两个来源的SSADH均为NADP+辅因子依赖的还原酶,催化活性非常高,并且展现了一定的底物抑制性。同时课题组揭示了该两个酶依赖NADP+辅因子的结构基础及催化机理(International Journal of Biological Macromolecules, 2018, 108: 615-624; PLoS ONE, 2020, 15(9): e0239372)。
此外,集胞藻PCC6803中的slr1022基因在三羧酸循环和精氨酸合成途径中均发挥了重要作用。课题组对Slr022蛋白展开了深入的动力学及催化机理研究。结果发现Slr022蛋白作为N-乙酰鸟氨酸转氨酶的催化能力是其作为GABA-AT催化能力的10700倍,同时Slr1022蛋白的催化机理也是典型的乒乓反应机理,其催化中心的关键氨基酸残基和其他N-乙酰鸟氨酸转氨酶的关键残基一致(International Journal of Molecular Sciences, 2023, 24: 5853)。
由于α-酮戊二酸和γ-氨基丁酸是蓝藻三羧酸循环途径中的重要中间代谢物,因此上述研究对于理解蓝藻的三羧酸循环途径具有一定的意义,同时也可为利用蓝藻生物合成相关化学品提供理论基础。
上述论文的第一完成单位均为江西农业大学,第一作者均为本院研究生,李志敏教授为论文通讯作者。相关论文链接如下:
1、http://dx.doi.org/10.1016/j.pep.2017.07.013
2、https://doi.org/10.1016/j.ijbiomac.2018.03.112
3、https://doi.org/10.1016/j.ijbiomac.2017.12.059
4、https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0239372
5、https://www.mdpi.com/1422-0067/24/6/5853
供稿:李志敏; 审核:郭柳华、吴晓玉

